
图源自Unsplash
日前,华芢生物科技(青岛)股份有限公司(以下简称“华芢生物”)在港交所递交招股书,拟主板上市,华泰国际、中信证券为联席保荐人。
华芢生物成立于2012年,致力于发现、开发和商业化伤口愈合的多功能疗法,当前重点是开发血小板衍生生长因子(PDGF)药物,用于治疗烫伤、糖尿病足溃疡。
根据招股书,2022年至2023年,华芢生物收入分别为0、47.2万元,净亏损各为8592.6万元、1.05亿元。
公司目前尚无任何商业化产品,2023年的一笔收入来自向单一客户提供与伤口愈合医疗器械项目相关的研究服务,非核心业务,公司经营主要依赖融资。
递表之前,华芢生物累计获得3轮融资,是青岛崂山“拼抢”来的国家级高新技术企业。2023年5月,华芢生物获得青岛崂山国资3亿元大额融资,公司也就此改名、搬迁。
两年估值翻4倍,签署多项对赌协议华芢生物成立的前9年时间,从未“伸手要钱”,直到在研药物管线一脚踏入临床阶段,公司开启密集融资,估值随之水涨船高。
2021年4月,其用于治疗糖足的核心在研PDGF药物(Pro-101-2)提交了IND申请,次月,公司完成Pre-A轮融资,彼时估值为8.05亿元。
同年7月,Pro-101-2获批临床,10月完成I期临床试验,表现出良好的安全性及耐受性。同时,公司完成A轮融资,鼎晖投资独家注资1亿元。短短5个月时间,公司估值增至20.21亿元。
近两年,各地招商引资力度加码,上海就抛出了“不看税收看业态、不看盈利看潜力、不看资历看团队”的招商新思维,宁波还喊出要“虎口夺食抢项目”的口号。而生物医药是各地的重点投资领域,有着国家级高新技术企业名号和临床阶段前沿管线加身的华芢生物,虽没有获批产品,但也有了一定的主动选择空间。
2022年,注册地在北京的华芢生物还未更名,公司董事长贾丽加一行曾赴秦皇岛参加考察交流座谈会,交流了公司核心项目情况及落地诉求等方面,与会相关负责人当时指出,华芢生物在研项目与秦皇岛市产业发展方向高度契合,要加快推动双方合作进程。但后续并无下文。
2023年4月,华芢生物与青岛崂山区签署合作协议,落地华芢生物总部项目,建设包括TPG凝胶在内的一类新药研发、生产、销售、办公总部基地。一个小插曲是,青岛日报曾报道称,2023年一季度青岛招商引资未达到预期目标。
5月,华芢生物变更注册地和公司名称,奔赴青岛,并宣布获得3亿元B轮融资,青岛高科独家投资,公司估值推高到33亿元,两年时间翻了4倍。

图源自天眼查
但无论是华芢生物去年获得的大额融资,亦或是此前拿到的A轮融资,都签有多项对赌协议,主要内容之一是要求公司首次公开发售要于2026年12月31日前完成,否则公司需购买其所持有的全部或部分股份。
每股赎回价为原发行价加上自代价支付日期起至赎回日期止按简单基准计算的年利率,A轮、B轮各自要求年利率为8%、6%,另外加上所有已宣派但尚未支付的股息的总和。

图源自招股书
因为前述B轮融资产生的赎回负债被列入其他金融负债,截至2023年末,华芢生物其他金融负债高达3.8亿元,负债金额增至1.32亿元,而在2022年,这两项负债数据分别为7794.6万元、5493.8万元。
从这个角度来说,华芢生物寻求上市也是为完成对赌,但从公司的费用支出以及账面金额来看,华芢生物对资金的需求并非“火烧眉毛”。截至2023年末公司现金及现金等价物为2.42亿元。
公司也认为其有足够的营运资金来支付至少125%的成本,包括至少未来12个月的研发费用、行政开支、财务成本和其他开支。
为核心管线“烧钱”的Ⅲ期临床提前储备资金华芢生物目前有10余款候选产品,覆盖多种适应症,涉及PDGF药物和mRNA药物和ASO药物。
其在研管线中有7款PDGF药物,适应症包括烧烫伤、糖足、新鲜创面、压疮、放射性溃疡、干眼症、角膜损伤、日光性皮炎、脱发、痔疮及胃溃疡,其中最为核心的是用于治疗烧烫伤的Pro-101-1和用于治疗糖足的Pro-101-2。
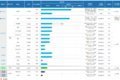
图源自招股书
目前,Pro-101-1采用中美双报,预期将于2026年第一季度向FDA提交IND申请,国内正处于IIb期临床试验,预计将在明年三季度启动Ⅲ期临床试验。
I 期临床试验是初步对人体安全性进行评价,II 期临床试验是初步评价药物对目标适应症患者的治疗作用和安全性,Ⅲ期临床试验是治疗作用确证阶段,样本量要远大于前两期试验,耗时耗资,一般需要3年左右时间,研发投入动辄数亿元。
从这一维度来看,此前两年,华芢生物研发费用不高,仅3481.8万元、3991.5万元,似乎与公司家级高新技术企业的名号不符,但这与公司在研管线所处的阶段关系密切。而一旦在研药物进入Ⅲ期临床试验,那么目前躺在华芢生物账上的资金就显得单薄了。
招股书披露的融资用途中,主要将用于核心产品Pro-101-1及Pro-101-2的持续临床开发,包括支付烧烫伤候选药物在中国开展IIb期及III期临床试验的第三方服务费及研发人员费用,在美国开展临床试验的第三方服务费及研发人员费用,以及支付在中国开展糖足候选药物的II期及III期临床试验的第三方服务费、研发人员费用。
根据弗若斯特沙利文报告,Pro-101-1是中国治疗烧烫伤临床开发进度最快的PDGF候选药物,有望成为国内首个获批的烧烫伤适应症的商业化的PDGF产品。该产品的预测获批时间是2027年。
另外一款用于治疗糖足的Pro-101-2,2022年2月获批II期临床试验,计划今年二季度启动患者入组程序,预计将于2027年第二季度完成。对于这一药物,华芢生物预期的商业化时间在2030年。
一方面,华芢生物核心管线尚未进入关键的临床III期,另一方面,III期临床阶段也被称为是新药研发的“麦城”。这让华芢生物的未来愁云密布。
值得注意的是,中国并无任何获批的PDGF药物,全球范围内,FDA仅批准的三种生长因子药物中,有一款用于治疗糖足的PDGF药物Regranex(贝长普勒明)。
在国内,天士力有一款PDGF候选药物于2014年进入III期临床试验,但之后并无有关天士力医药可用药物管线状态的最新进展资料。
华芢生物的重要管线确实具有技术前沿性,但距离公司预计的商业化节点,至少还有3年时间,无产品可卖、亏损扩大、研发高企几乎已是板上钉钉。
(本文首发于钛媒体App 作者丨杨亚茹 编辑丨孙骋)
友情提示
本站部分转载文章,皆来自互联网,仅供参考及分享,并不用于任何商业用途;版权归原作者所有,如涉及作品内容、版权和其他问题,请与本网联系,我们将在第一时间删除内容!
联系邮箱:1042463605@qq.com